生命中心彭敏课题组发现一种全新的T细胞状态
2024年3月26日,生命中心PI、清华大学基础医学院彭敏副教授团队在《Journal of Experimental Medicine》杂志发表题为“Induction of immortal-like and functional CAR T cells by defined factors”的研究论文。该研究报道了一种全新的T细胞状态,即类永生化功能性T细胞(Immortal-like and Functional T cells),简称TIF。TIF具备类似于诱导多功能干细胞(iPSCs)那样接近于无限的自我更新能力,同时完整保留了成熟T细胞的生理功能,具有重要的理论和应用价值。

以嵌合型抗原受体(Chimeric Antigen Receptor, CAR)T细胞为代表的细胞疗法是近年来肿瘤治疗最重要的进展。但是,目前的CAR T细胞疗法仍然存在诸多问题,其中CAR T细胞在患者体内的持久性行不足是治疗后肿瘤复发的重要原因。因此,如何延长CAR T细胞的持久性是领域内的前沿重点研究方向。
现有理论认为,T细胞在体内的持久性由其干性(stemness)决定,那些表现出干性特征(stem-like)的T细胞亚群具备较好的自我更新能力,因而可以在体内长期存在。如何使得T细胞获得真正的干性是领域内一直以来未能彻底解决的重大难题。这一难题可能是T细胞免疫应答的固有特征和干细胞的内在特性所决定的。T细胞应答的一个显著特征是克隆扩增后的大规模收缩(contraction),这导致只有少数细胞(~5%)能够分化为记忆性T细胞长期存在。因此,在免疫应答后期维持大量的抗原特异性T细胞不符合T细胞应答的自然规律。同样,哺乳动物体内具备自我更新能力的细胞(如干细胞和前体细胞等)的数量是极为稀少的。因而,在哺乳动物体内维持大量具备真正干性的细胞不符合干细胞的稀缺性特点。此外,对于哺乳动物细胞而言,干性通常与功能性相冲突。一个最为明显的例子是iPSCs的诱导,所有体细胞在过表达 Yamanaka因子变为iPSCs后,无一例外地失去原有的体细胞谱系特征和功能。因此,要想使得成熟的体细胞(包括T细胞)通过重编程获得真正的干性,同时保留其原有生理功能是一个极具挑战也尚未实现的难题。
为了解决这一难题,彭敏课题组通过两轮筛选发现了基因组中一个奇妙的基因敲除组合,即Bcor和Zc3h12a。在CAR T细胞中同时敲除这两个基因,而不是单个基因敲除,使得CAR T细胞在获得类似iPSCs那样无限的干性,同时保留了T细胞的生理功能。这种T细胞被命名为类永生化功能性T细胞,简称TIF。临床上常用的CD19 CAR T细胞被诱导为TIF后(简称CAR19TIF),表现出了接近无限的干性。在检验哺乳动物细胞干性金标准的连续传代实验中,CAR19TIF在无需任何预处理的条件下可连续传代6次不表现出任何耗竭的迹象(图1)。类似的条件下造血干细胞(HSCs)仅能连续传代3~5次,因而CAR19TIF的干性远超HSCs,更接近iPSCs。
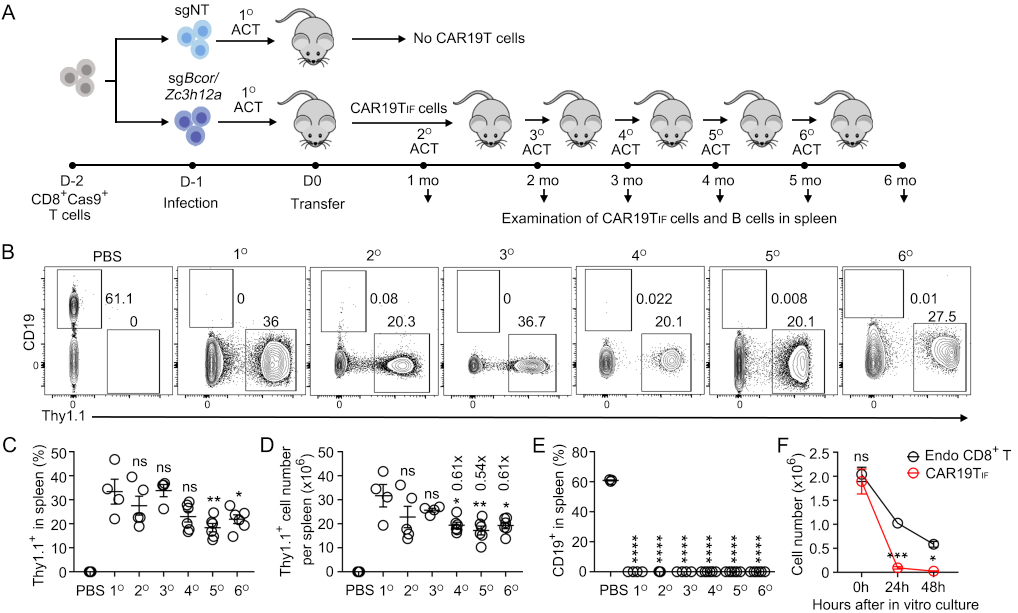
图1.CAR19TIF具有超强的干性
(A)CAR19TIF连续传代实验流程图。(B) 流式细胞术检测CAR19TIF在小鼠体内的比例以及对靶细胞的杀伤。(C-D) 小鼠脾脏中CAR19TIF的比例和数量统计结果。(E) 小鼠脾脏中靶细胞比例的统计结果。(F) 体外培养的CAR19TIF细胞数量统计结果。
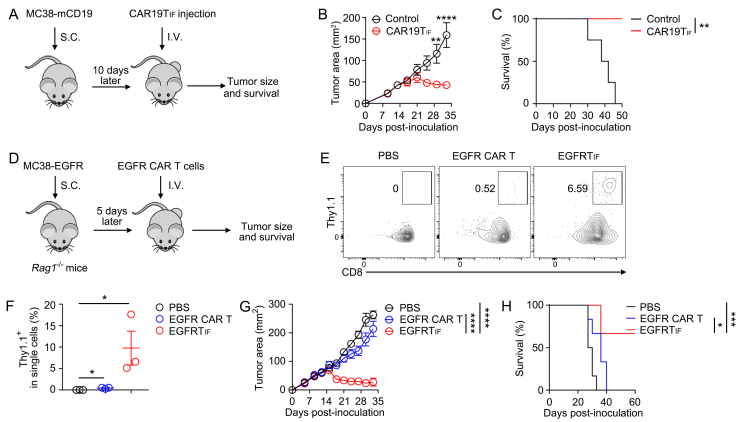
同时,CAR19TIF表现出了超强的功能性,500个CAR19TIF即可清除小鼠体内数以亿计的靶细胞(图2)。需要指出的是,CAR19TIF并没有转变为肿瘤细胞,其不能在体外存活,也不能在严重免疫缺陷的NSG小鼠中扩增和存活,不具备成瘤性。
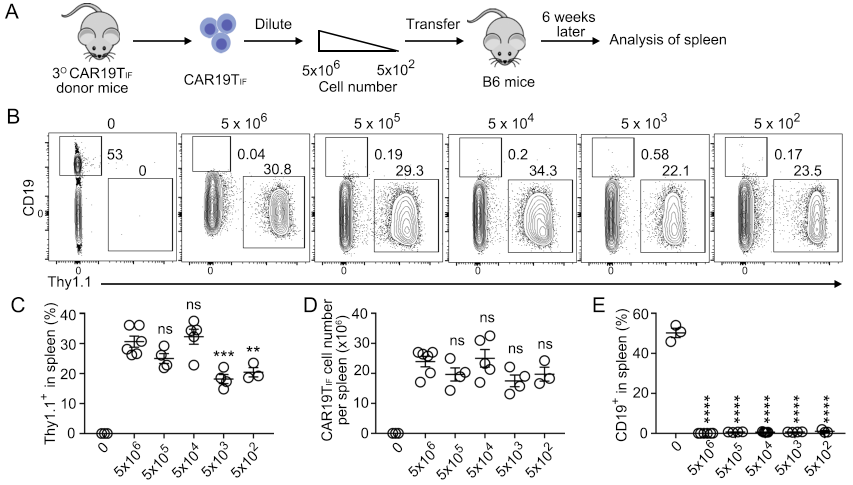
图2.CAR19TIF具有超强的功能性
(A) 过继移植不同数量CAR19TIF实验流程图。(B) 流式细胞术检测不同数量CAR19TIF在小鼠体内的重建结果以及对靶细胞的杀伤。(C-D) 小鼠脾脏中CAR19TIF的比例和数量统计结果。(E) 小鼠脾脏中靶细胞比例的统计结果。
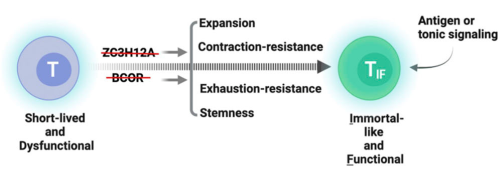
CAR19TIF表现为CD44hiCD62LhiPD-1hiCX3CR1hiFSClow,同时具备干性和功能性的特征,这与之前报道的长寿命T细胞,包括记忆性T细胞(TCM),干细胞样记忆性T细胞(TSCM)以及耗竭前体T细胞(TPEX)等均有显著差异。此外,CAR19TIF和近期报道的ISTC(CD62LnegTCF1intTIM-3hi)也有明显差异。因此,TIF代表了一种全新的T细胞状态。其中,CAR19TIF的细胞大小(cell size)显著小于初始T细胞(naïve T cells)这一特征是所有其它T细胞都不具备的。与其细胞大小对应,CAR19TIF在清除靶细胞后进入一种代谢冬眠的状态,其营养物质的摄取和代谢活性显著低于初始T细胞。这打破了长寿命T细胞线粒体活性增加这一常见观点,进一步显示出CAR19TIF的不同之处。 在各种肿瘤模型中,基于TIF的CAR T细胞均表现出了显著的抗肿瘤效应,并延长小鼠的生存时间(图3)。最后,TIF也可在人的T细胞中诱导,并表现出和小鼠TIF细胞类似的特征。 图3.CAR19TIF和EGFRTIF具有显著的抗肿瘤功能 (A)CAR19TIF治疗肿瘤实验流程图。(B) 肿瘤大小统计结果。(C) 荷瘤小鼠生存曲线。(D)EGFRTIF治疗肿瘤实验流程图。(E,F)流式细胞术检测荷瘤小鼠外周血中EGFR CAR T细胞比例。(G) 肿瘤大小统计结果。(H) 荷瘤小鼠生存曲线。 总之,该研究发现了一种全新的T细胞状态(图4),TIF。TIF具备类似于iPSCs那样接近于无限的自我更新能力,同时完整保留了成熟T细胞的生理功能,具有重要的理论和应用价值。 图4. TIF细胞诱导模式图 彭敏为该论文通讯作者,课题组博士后王丽霞、金刚(彭敏实验室2017级博士生)和周秋萍为该论文共同第一作者,2020级博士生刘岩岩也为该论文做出了重要贡献。感谢该项目中人CAR T细胞制备过程中生命中心林欣实验室的提供的技术帮助,同时感谢清华大学董晨实验室提供的电转仪。该研究获得了国家自然科学基金委员会、万科基金、清华大学笃实项目、成品直播app大全免费下载、山西医科大学-清华大学医学院前沿医学协同创新中心、清华大学免疫学研究所、分子肿瘤学全国重点实验室等资助。彭敏课题组长期致力于T细胞基础和应用研究,欢迎博士生和博士后加入!有意者请联系pengmin@tsinghua.edu.cn。 原文链接:https://doi.org/10.1084/jem.20232368